o Ajuste induzido-A teoria remonta a Koshland e corresponde a uma extensão do princípio da fechadura com chave, que se baseia na precisão do ajuste das estruturas anatômicas. O ajuste induzido refere-se a enzimas, como a quinase, que mudam sua conformação para formar um complexo enzima-ligante. No caso de defeitos enzimáticos, o princípio de ajuste induzido pode ser afetado por distúrbios.
O que é ajuste induzido?

Muitos processos no corpo funcionam com base no princípio da fechadura com chave ou da mão na luva. Isso se aplica, por exemplo, a conexões articuladas. A cabeça da junta se encaixa no soquete da junta como uma chave em uma fechadura ou uma mão em uma luva. A porta só abre quando a chave está exatamente na fechadura. No mesmo contexto, certas funções do corpo só são abertas quando as estruturas se encontram com precisão.
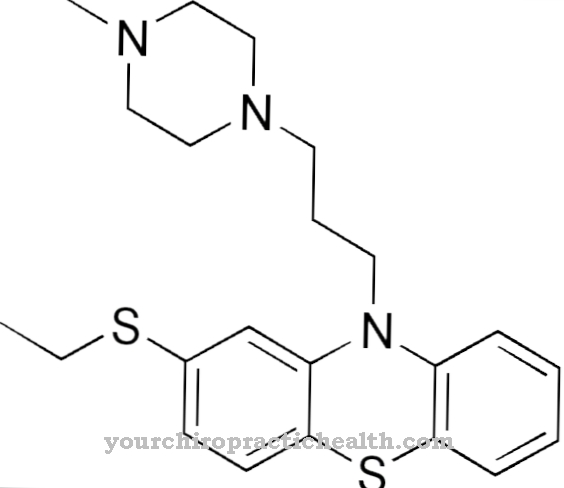
O ajuste induzido é uma forma especial do princípio chave na fechadura. Esta é uma teoria para a formação de complexos proteína-ligante, por exemplo, um complexo enzima-substrato no contexto de reações catalisadas por enzima.
Daniel E. Koshland é considerado o primeiro a descrever a teoria e postulou-a pela primeira vez em 1958. Ao contrário do princípio da fechadura com chave, a teoria do ajuste induzido não assume duas estruturas estáticas. No caso de complexos proteína-ligante em particular, uma mudança conformacional na proteína envolvida deve permitir que o complexo seja formado. Ligante e proteína, ou melhor, enzima, Koshland via como dinâmica e falava de uma interação que move ambos os parceiros para uma mudança na conformação em prol da formação do complexo.
Função e tarefa
Existe especificidade de ligação entre enzimas e substratos. Esta especificidade de ligação implica o princípio de bloqueio de chave. Cada enzima possui um centro ativo. Para a formação de complexos com um ligante, este centro é precisamente moldado de tal forma que quase perfeitamente corresponde à forma espacial do substrato pretendido.
No caso de muitas enzimas, entretanto, o centro ativo em cada caso está em uma forma que não é muito precisa, desde que não esteja ligado a um substrato. Essa observação parece contradizer o princípio de chave e fechadura, porque as enzimas e seus ligantes parecem inicialmente adaptar sua forma.
Assim que a enzima se liga a um ligante, são criadas interações intermoleculares. Essas interações no nível intermolecular levam a uma mudança na conformação da enzima. A conformação é entendida como significando os vários arranjos possíveis de átomos individuais em uma molécula que resultam de uma rotação simples em torno de um eixo. A mudança na conformação das enzimas corresponde a uma mudança no arranjo espacial de suas moléculas e só permite a formação de um complexo enzima-substrato.
A hexoquinase como enzimas catalisam, por exemplo, a primeira etapa da glicólise. Assim que essas enzimas entram em contato com o substrato glicose, pode-se observar um ajuste induzido no sentido da formação de um "ajuste induzido". A enzima hexoquinase fosforila sua glicose ligante ao consumir ATP para formar uma glicose-6-fosfato.
A estrutura da água se assemelha à do grupo alcoólico do átomo C6, que a enzima fosforila durante a reação. Devido ao pequeno tamanho, as moléculas de água poderiam se ligar ao centro ativo da enzima, de modo que a hidrólise do ATP seria gerada. No entanto, o ajuste induzido permite que a hexoquinase catalise a conversão da glicose com alta especificidade, de modo que a hidrólise do ATP deve ocorrer em pequena extensão. Com o mecanismo de ajuste induzido, a especificidade do substrato aumenta.
O princípio dentro do organismo humano pode ser observado particularmente no caso das quinases. A adaptação induzida não se aplica a todos os complexos ligante-receptor, uma vez que a mudança conformacional de ambos os parceiros é, em muitos casos, limites naturais.
Doenças e enfermidades
O princípio de ajuste induzido é perturbado no caso de diferentes defeitos enzimáticos. Na fenilcetonúria, por exemplo, as enzimas têm sua atividade restrita ou falham completamente. Normalmente, isso se deve a um defeito genético. Na fenilcetonúria, a enzima fenilalanina hidroxilase é defeituosa. A fenilalanina não é mais convertida em tirosina e se acumula em conformidade. Surgem substâncias neurotóxicas, de modo que, além das deficiências mentais, o paciente tem tendência a cãibras. Os defeitos enzimáticos são geralmente genéticos e causados por uma sequência de aminoácidos codificada incorretamente no DNA.
As doenças metabólicas causadas por defeitos enzimáticos e esse princípio de ajuste induzido perturbado são conhecidas como enzimopatias. Os defeitos da piruvato quinase estão presentes, por exemplo, em um gene PKLR que codifica incorretamente. Este gene está localizado no locus gênico 1q22 do cromossomo 1. São conhecidas várias mutações do alelo PKLR da piruvato quinase, que aparecem como defeitos na forma R.
A doença dela é novamente referida como glicogenose tipo VI e pertence ao grupo das doenças de armazenamento de glicogênio. É um distúrbio metabólico autossômico recessivo ou ligado ao X devido a defeitos enzimáticos. Mais precisamente, a causa está em diferentes defeitos enzimáticos no sistema da fosforilase quinase no fígado e nos músculos. Neste contexto, por exemplo, o defeito da fosforilase-b-quinase ligada ao X no fígado, o defeito da fosforilase do fígado da herança autossômica recessiva e a falha combinada da fosforilase-b-quinase no fígado e nos músculos são conhecidos.
Em conexão com a fosforilase hepática, as mutações causais foram localizadas no gene PYGL e, portanto, estão no cromossomo 14q21 a q22. A deficiência combinada de fosforilase do músculo hepático foi associada a mutações no gene PHKB no locus 16q12-q13. Mutações causais no gene PHKA2 no locus Xp22.2-p22.1 foram identificadas para o defeito ligado ao X na fosforilase quinase do fígado. Outras glicogenoses também podem cancelar o efeito de ajuste induzido da quinase correspondente ou torná-lo mais difícil.







.jpg)