A proteína Tropomiosina ocorre principalmente nos músculos estriados e participa da contração muscular. Mutações genéticas podem afetar a estrutura das moléculas de tropomiosina produzidas e, portanto, causar uma série de doenças - incluindo várias formas de cardiomiopatia, bem como artrogripose múltipla congênita e miopatia nemalina.
O que é tropomiosina?
A tropomiosina é uma proteína encontrada no corpo humano principalmente nos músculos esqueléticos. O bioquímico Kenneth Bailey descreveu a proteína pela primeira vez em 1946. Um único músculo consiste em muitos feixes de fibras musculares, que por sua vez consistem em fibras musculares.
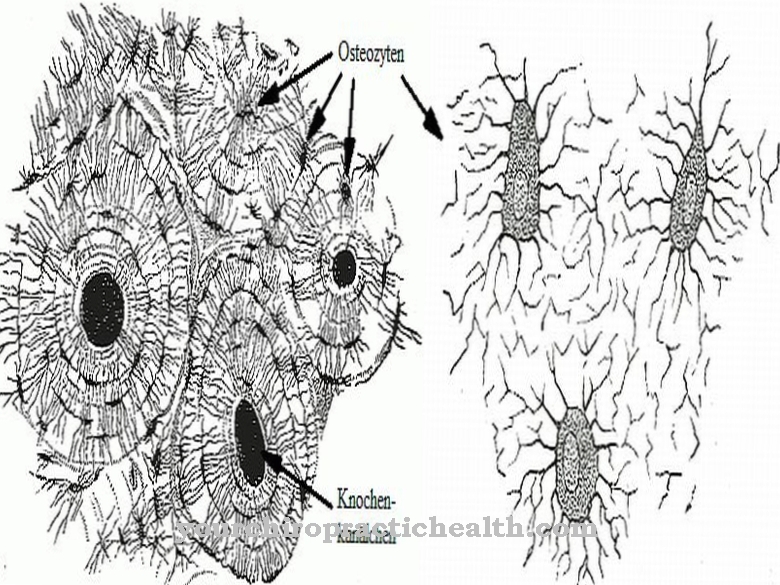
Cada fibra não é composta por uma única célula muscular claramente definida, mas por um tecido com muitos núcleos celulares. Dentro dessas unidades, as miofibrilas representam fibras mais finas; suas seções transversais são chamadas de sarcômeros. Um sarcômero é composto de dois tipos de fios que são empurrados alternadamente um no outro, como uma engrenagem ou zíper. Algumas dessas fitas são miosina, as outras são um complexo de actina e tropomiosina. Neste complexo, as moléculas de actina formam uma cadeia espessa em torno da qual duas fitas de tropomiosina são enroladas.
Anatomia e estrutura
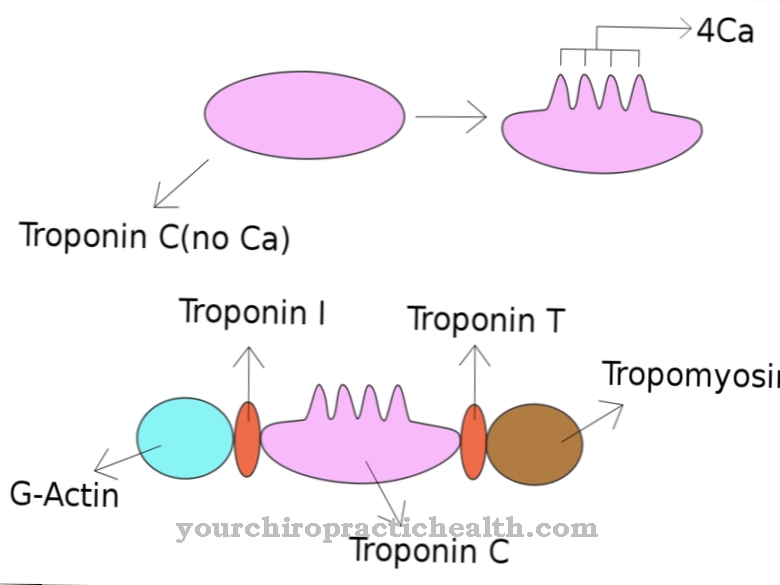
A tropomiosina consiste em duas partes: α e β. Os dois blocos de construção têm um total de 568 aminoácidos, dos quais 284 são α-tropomiosina e 284 são β-tropomiosina. Esses aminoácidos se alinham em uma fileira e formam longas cadeias antes de finalmente se unirem para formar uma macromolécula em forma de bastonete.
A sequência dos aminoácidos e a estrutura da proteína são determinadas geneticamente; em humanos, os seguintes genes são responsáveis por isso: TPM1 no 15º cromossomo, TPM2 no 9º cromossomo, TPM3 no primeiro cromossomo e TMP4 no 19º cromossomo. A fita de tropomiosina (com ambas as subunidades) envolve os filamentos de actina mais grossos nos músculos esqueléticos estriados. A troponina, outra proteína, também está ligada a ele.
Função e tarefas
A tropomiosina é necessária para que o músculo esquelético se contraia. Quando um impulso nervoso atinge o músculo, o estímulo elétrico inicialmente se espalha através do sarcolema e dos túbulos T e, finalmente, leva à liberação de íons de cálcio no retículo sarcoplasmático.
Os íons ligam-se temporariamente à troponina, que está localizada na fita de tropomiosina. Como resultado, os íons de cálcio alteram as propriedades físicas da molécula. A troponina muda ligeiramente na superfície e, portanto, se afasta dos locais onde a miosina também pode se ligar. A miosina forma as fibras complementares ao complexo actina / tropomiosina. No final do filamento de miosina, existem duas chamadas cabeças. As cabeças de miosina podem se ligar às áreas do filamento de actina que não são mais ocupadas pela troponina.
Depois de se encaixarem na fibra, as cabeças da miosina dobram-se e se empurram entre os filamentos de actina / tropomiosina, o que encurta o sarcômero. Ao mesmo tempo, esse processo acontece não apenas em um sarcômero, mas em muitos. Os numerosos sarcômeros contraídos, portanto, fazem com que a fibra muscular e, portanto, o músculo como um todo se contraiam. Um sinal nervoso freqüentemente estimula várias centenas de fibras musculares. O efeito plastificante do trifosfato de adenosina (ATP) permite que a cabeça da miosina se desprenda da actina.
A contração dos músculos lisos é um pouco diferente. Os músculos lisos circundam os órgãos humanos ou são encontrados nas paredes dos vasos sanguíneos. Ele pode contrair mais do que músculos estriados. Enquanto os músculos esqueléticos têm uma estrutura estriada, os músculos lisos formam uma superfície plana composta de células individuais. Além da actina e da tropomiosina, os músculos lisos possuem caldesmon e calmodulina, duas outras proteínas, cuja interação influencia a tensão nos músculos. A tropomiosina atua principalmente na calmodulina.
Além disso, a tropomiosina também desempenha um papel em outros processos biológicos. Por exemplo, parece influenciar a ligação da actina no citoesqueleto e ter um efeito na divisão celular.
Doenças
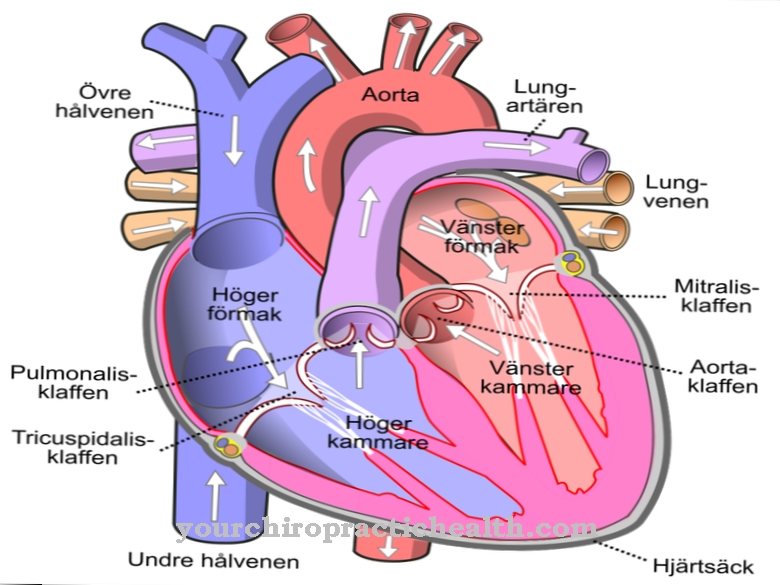
Uma doença que pode estar relacionada à tropomiosina é a cardiomiopatia hipertrófica. Esta é uma doença cardíaca em que os sarcômeros (seções das fibras musculares) são espessados, o que também afeta a espessura das fibras musculares como um todo.
Como resultado, podem ocorrer sintomas como sensação de pressão no peito, tontura, falta de ar, síncope e ataques de angina. Nesse caso, voltam a problemas funcionais do músculo cardíaco. A causa mais comum (40–60%) da cardiomiopatia hipertrófica está nos genes: alterações (mutações) levam a erros no código genético e, consequentemente, à síntese incorreta de proteínas. Isso também pode afetar as várias proteínas que constituem as fibras musculares.
Na cardiomiopatia restritiva, o músculo cardíaco fica rígido. A causa é um excesso de tecido conjuntivo. A cardiomiopatia restritiva leva à insuficiência cardíaca, que normalmente é caracterizada por distúrbios respiratórios, edema, tosse seca, fadiga, exaustão, tontura, síncope, palpitações e vários distúrbios digestivos. Os afetados têm menos probabilidade de se confundir, sofrer de problemas de memória ou desempenho cognitivo prejudicado. A cardiomiopatia dilatada também pode ser decorrente de um erro nos genes da tropomiosina.
Quando esta doença cardíaca se manifesta, geralmente está associada a insuficiência cardíaca global e / ou insuficiência cardíaca esquerda progressiva. Além disso, podem surgir distúrbios respiratórios, embolias e arritmias cardíacas. Duas outras doenças que podem estar relacionadas à tropomiosina e são parcialmente baseadas em mutações são a miopatia nemalina, na qual os músculos podem ser prejudicados de várias maneiras, e a artrogripose congênita múltipla, na qual as articulações enrijecem. No entanto, todas essas doenças também podem ter outras causas; as mutações nos genes da tropomiosina são apenas uma possibilidade.