- O que é um átomo?
- Como um átomo é formado?
- Como os átomos se combinam?
- Partes de um átomo
- História do átomo
- Molécula
Explicamos o que é um átomo e como cada uma de suas partes é composta. Além disso, sua história, estudos sobre ela e o que é uma molécula.

O que é um átomo?
A menor unidade que constitui o importam.
A palavra átomo vem do grego antigo (átomo, "Sem divisão") e foi cunhado pelos primeiros filósofos para teorizar sobre a composição das coisas, ou seja, as partículas elementares do universo. Desde então, com o surgimento do modelos atômicos, a forma de imaginá-los variou enormemente, à medida que um modelo atômico sucedendo ao anterior ao longo dos séculos, até chegarmos ao que usamos hoje.
Os átomos têm as propriedades de Elemento químico que compõem e, por sua vez, os elementos são organizados e classificados de acordo com seus números atômicos, configuração eletrônica e propriedades químicas em Tabela periódica dos elementos.
O mesmo elemento químico pode ser composto por diferentes átomos da mesma classe, ou seja, com o mesmo número atômico (número de prótons que cada átomo possui no elemento), embora suas massas atômicas sejam diferentes.
Por exemplo, existem diferentes átomos do mesmo elemento que diferem em seu número de nêutrons, e são chamados de isótopos, um caso representativo são os isótopos do elemento carbono (12C, 13C, 14C). Portanto, cada átomo pertence ao mesmo elemento químico ou não, dependendo do seu número de prótons, então átomos com o mesmo número de prótons pertencem ao mesmo elemento químico.
Como um átomo é formado?
Os átomos são compostos de um núcleo e um ou mais elétrons (que têm uma carga negativa) ao seu redor. O núcleo é feito de partículas chamadas prótons e nêutrons. Os prótons são carregados positivamente e os nêutrons são neutros. O conjunto de prótons e nêutrons são chamados de núcleons.
Prótons e elétrons são atraídos uns aos outros pela força eletromagnética (a interação de partículas carregadas com campos elétricos e magnéticos), enquanto prótons e nêutrons são atraídos uns aos outros pela força nuclear (uma força experimentada apenas pelas partículas que compõem o núcleo atômico).
Como os átomos se combinam?
Os átomos podem se combinar entre si para formar ligações químicas, o que acontece quando eles compartilham seus elétrons de uma forma ou de outra. Ligações químicas podem ser covalente, iônico Y metálico, que origina compostos moleculares covalentes, redes iônicas ou compostos metálicos (embora seja importante esclarecer que nenhuma ligação química é absolutamente covalente ou iônica). Desta forma, os átomos podem se combinar para formar moléculas simples como o Água, bem como para formar macro moléculas complexo como proteína, DNA Y RNA.
Embora os átomos sejam distintos uns dos outros graças à configuração de suas partículas, também é verdade que todos os átomos do mesmo elemento são exatamente idênticos: os átomos de hidrogênio no sol Eles são iguais aos que constituem o nosso corpo, e os átomos de carbono no corpo de um cão são idênticos aos que constituem um diamante. A diferença está na maneira como os átomos se combinam para constituir os diferentes compostos químicos que constituem os órgãos e sistemas de órgãos no seres vivos, os materiais gerados no indústria, e toda a matéria que constitui o universo.
Partes de um átomo
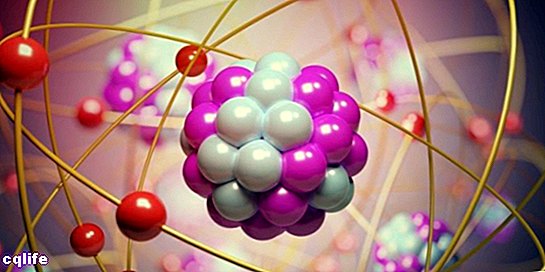
Os átomos são compostos por duas partes essenciais:
- O núcleo. Cerca de 99,94% da massa de um átomo está concentrada no núcleo, onde os prótons e nêutrons (que juntos são chamados de "núcleons") estão, unidos por fortes forças nucleares, o que impede que os prótons se repelam, tendo as mesmas características elétricas cobrar.
- Os orbitais atômicos. Um orbital descreve uma região do espaço em torno do núcleo atômico em que o probabilidade encontrar um elétron é muito alto. Essas regiões têm diferentes formas que são obtidas como resultado da resolução da equação de Schrödinger estacionária. Erwin Schrödinger foi um cientista austríaco que desenvolveu essa equação em 1925 para calcular a evolução de uma partícula subatômica, como os elétrons. Assim, os elétrons formam uma espécie de "nuvem" em torno do núcleo, que é representada pela forma dos orbitais atômicos. Por outro lado, cada orbital atômico corresponde a um determinado valor de energia para os elétrons, portanto, eles são organizados de acordo com seus valores de energia. A figura a seguir mostra as formas dos primeiros orbitais atômicos:

História do átomo

O primeiro a formular a ideia da existência de átomos foi o filósofo grego Demócrito (s.V-VI BC) de especulações puramente imaginárias (como a ciência era entendida naquela época).
Seus estudos foram retomados por filósofos posteriores, como Leucipo e Epicuro, mas foram negligenciados durante o medieval, ofuscado pela explicação criacionista do mundo, que atribuía tudo a Deus.
Tivemos que esperar até 1773, quando o químico francês Antoine de Lavoisier postulou sua teoria sobre a não criação ou destruição da matéria (ela apenas transforma) ou Lei da conservação de massa, que permitiu a John Dalton formular a primeira teoria atômica moderna em 1804.
Sucessivos acadêmicos do físico e a química eles foram inspirados por seu trabalho para propor sistemas melhores e mais complexos para a compreensão das partículas fundamentais da matéria. Posteriormente, novos modelos atômicos foram propostos até os mais utilizados hoje.
A estrutura contemporânea aceita é aquela derivada do experimentos de Rutherford em 1911, junto com as formulações de Niels Bohr, Schrödinger e Heisenberg.
Molécula
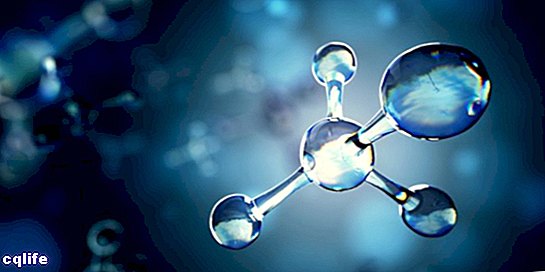
Uma molécula é conhecida como a união de dois ou mais átomos por meio de ligações químicas para formar uma estrutura mais complexa e eletricamente neutra. As ligações químicas podem ser covalentes ou iônicas.
As moléculas podem ser constituídas por átomos do mesmo elemento químico, por exemplo, a molécula de oxigênio (O2), ou por átomos de diferentes elementos químicos, por exemplo, a molécula de glicose. Gases monoatômicos, por exemplo hélio (He), também são considerados moléculas.

